TIANSeq DirectFast Library Kit (illumina)
Fitur
Keseragaman urutan yang baik: Tidak ada bias basa dari proses fragmentasi DNA dan proses amplifikasi PCR.
Efisiensi konversi perpustakaan yang tinggi: konstruksi perpustakaan dengan efisiensi tinggi dapat dipastikan untuk sampel DNA 1 ng.
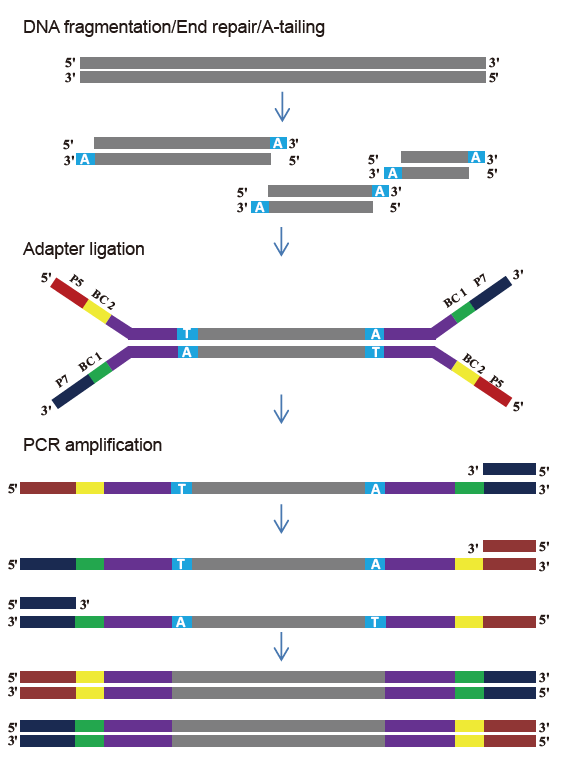
Pengoperasian cepat: Seluruh proses pembangunan perpustakaan hanya membutuhkan waktu 2,5 jam.
Hemat biaya: Tidak diperlukan instrumen dan peralatan khusus。
Spesifikasi
Jenis: Persiapan perpustakaan DNA untuk platform pengurutan throughput tinggi ilumina
Sampel: DNA genom atau DNA fragmen besar
Target: DNA untai ganda
Mulai masukan sampel: 1 ng- 1 g
Waktu operasi: 2,5 jam
Aplikasi hilir: Urutan pada platform ilumina
Semua produk dapat disesuaikan untuk ODM/OEM. Untuk detailnya,silahkan klik Layanan yang Disesuaikan (ODM/OEM)
Masukan sampel yang fleksibel dan ukuran yang terfragmentasi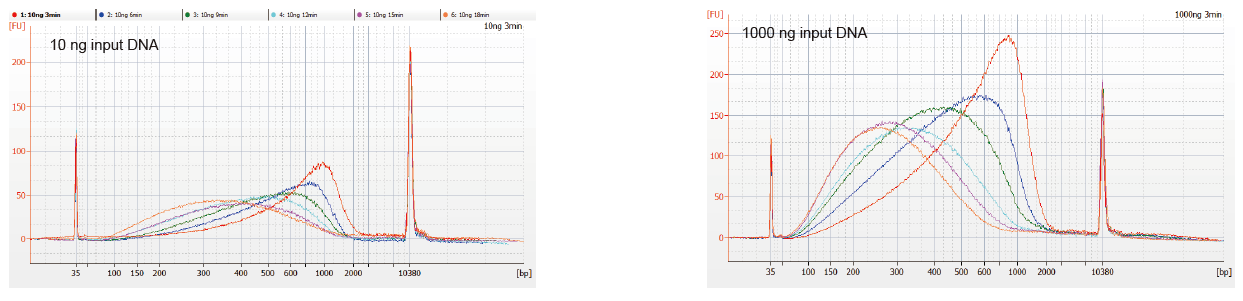 |
Gambar 1. Profil fragmentasi DNA dari waktu reaksi yang berbeda. 10 ng dan 1000 ng DNA difragmentasi menggunakan TIANSeq DirectFast DNA Library Kit. Produk reaksi yang diperlakukan dengan waktu reaksi yang berbeda dimurnikan dengan manik-manik magnetik 1,8× Ampure XP dan dianalisis dengan Angilent 2100. |
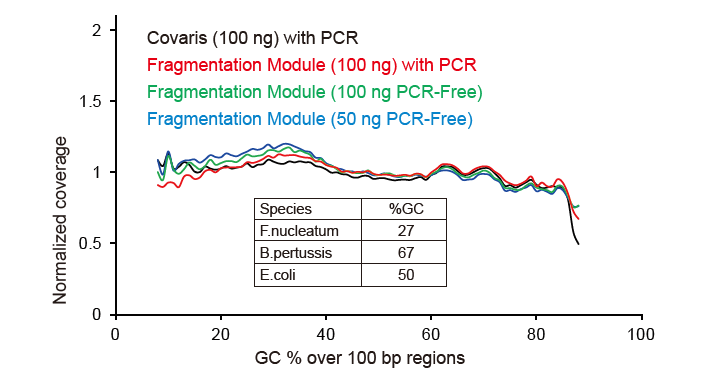
Cakupan Pengurutan Seperti Covaris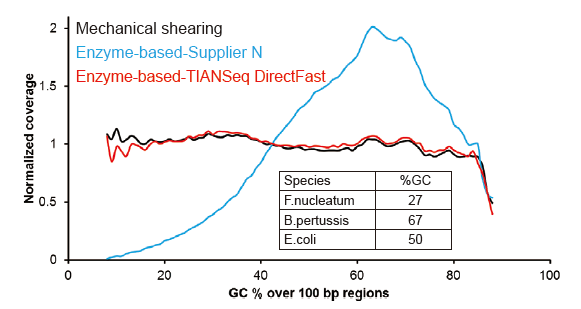 |
Gambar 2. Perbandingan cakupan genom metode persiapan perpustakaan yang berbeda. Tiga DNA genom bakteri dengan kandungan GC yang berbeda dicampur equimolar, dan sekuensing genom hasil cakupan 100 ng dari perpustakaan DNA campuran yang menggunakan metode ini dibandingkan. Hasilnya menunjukkan bahwa TIANSeq DirectFast Library Kit memiliki efek yang sama pada fragmentasi DNA seperti pemotongan mekanis, dan tidak ada bias basa untuk fragmentasi. |
Tidak Ada Bias Sistematis untuk Input DNA Serendah 1 ng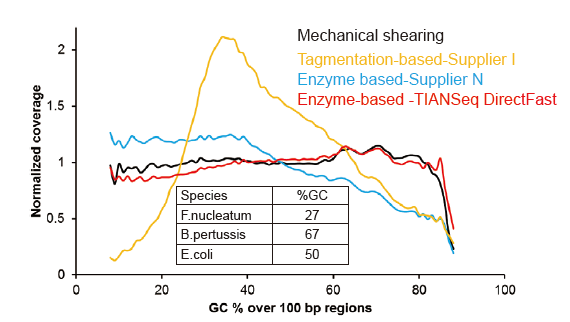 |
Gambar 3. Perbandingan cakupan genom metode persiapan perpustakaan yang berbeda. Tiga DNA genom bakteri dengan kandungan GC yang berbeda dicampur equimolar, dan sekuensing hasil cakupan genom dari 1 ng perpustakaan DNA campuran menggunakan metode ini dibandingkan. Hasilnya menunjukkan bahwa TIANSeq DirectFast Library Kit memiliki efek fragmentasi yang konsisten dengan geseran mekanis bahkan untuk input DNA serendah 1 ng, dan tidak ada bias basa. |
| Mampu Alur Kerja Bebas PCR
|
Gambar 4. Input DNA genom yang berbeda digunakan untuk membangun perpustakaan dengan PCR atau konstruksi perpustakaan bebas PCR, dan hasil cakupan genom dibandingkan. Hasil menunjukkan bahwa dengan operasi satu tabung dan langkah konstruksi perpustakaan yang efisien, perpustakaan DNA yang dibangun dengan TIANSeq DirectFast Library Kit mempertahankan konsistensi tinggi dengan geser mekanis dalam distribusi cakupan urutan fragmen untuk kedua pengayaan PCR alur kerja bebas PCR. |
Statistik Efisiensi dan Hasil Konstruksi Perpustakaan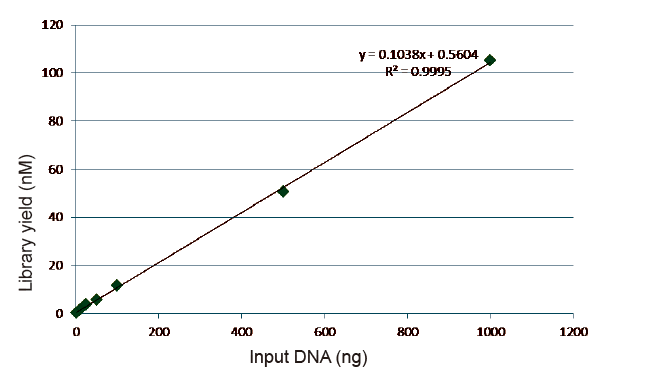 |
Gambar 5. Hasil analisis kuantitatif DNA perpustakaan yang diperoleh dengan qPCR setelah konstruksi perpustakaan dengan metode bebas PCR untuk sampel dengan jumlah awal yang berbeda (1, 10, 25, 50, 100, 500,1000 ng). Analisis regresi linier menunjukkan bahwa hasil perpustakaan memiliki hubungan linier yang baik dalam rentang masukan sampel yang luas. Untuk input DNA serendah 1 ng, efisiensi konstruksi perpustakaan tidak berkurang. |
Perbandingan Data Sequencing dari Berbagai Produk
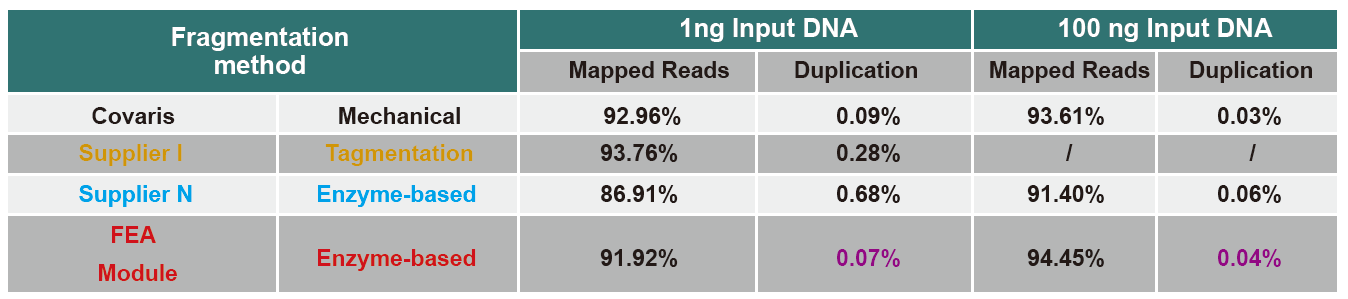
Saat ini, teknologi pengurutan throughput tinggi terutama didasarkan pada teknologi pengurutan generasi berikutnya. Karena panjang pembacaan teknologi pengurutan generasi berikutnya terbatas, kita harus memecah urutan panjang penuh menjadi pustaka fragmen kecil ke urutan. Sesuai dengan kebutuhan eksperimen pengurutan yang berbeda, kami biasanya memilih pengurutan ujung tunggal atau pengurutan ujung ganda. Saat ini fragmen DNA dari perpustakaan sekuensing generasi berikutnya umumnya didistribusikan dalam kisaran 200-800 bp.

a) DNA berkualitas buruk dan mengandung inhibitor. Gunakan sampel DNA berkualitas tinggi untuk menghindari penghambatan aktivitas enzim.
b) Jumlah sampel DNA tidak mencukupi bila menggunakan metode bebas PCR untuk membangun perpustakaan DNA. Ketika input DNA yang terfragmentasi melebihi 50 ng, alur kerja bebas PCR dapat dilakukan secara selektif selama proses konstruksi perpustakaan. Jika jumlah salinan perpustakaan terlalu rendah untuk diurutkan secara langsung, perpustakaan DNA dapat diperkuat oleh PCR setelah ligasi adaptor.
c) Kontaminasi RNA menyebabkan kuantifikasi DNA awal yang tidak akurat Kontaminasi RNA mungkin ada dalam proses pemurnian DNA genom, yang dapat menyebabkan kuantifikasi DNA yang tidak akurat dan pemuatan DNA yang tidak mencukupi selama konstruksi perpustakaan. RNA dapat dihilangkan dengan memperlakukan dengan RNase.
A-1
a) Fragmen kecil (60 bp-120 bp) muncul Fragmen kecil biasanya merupakan fragmen adaptor atau dimer yang dibentuk oleh adaptor. Pemurnian dengan manik-manik magnetik Agencourt AMPure XP dapat secara efektif menghilangkan fragmen adaptor ini dan memastikan kualitas pengurutan.
b) Fragmen besar muncul di perpustakaan setelah amplifikasi PCR Ukuran fragmen DNA perpustakaan akan meningkat 120 bp setelah adaptor diikat. Jika fragmen DNA meningkat lebih dari 120 bp setelah ligasi adaptor, mungkin disebabkan oleh amplifikasi fragmen abnormal dari amplifikasi PCR yang berlebihan. Mengurangi jumlah siklus PCR dapat mencegah situasi tersebut.
c) Ukuran fragmen DNA perpustakaan yang tidak normal setelah ligasi adaptor Panjang adaptor dalam kit ini adalah 60 bp. Ketika kedua ujung fragmen diikat ke adaptor, panjangnya hanya akan bertambah 120 bp. Saat menggunakan adaptor selain yang disediakan oleh kit ini, harap hubungi pemasok untuk memberikan informasi yang relevan seperti panjang adaptor. Harap pastikan bahwa alur kerja dan operasi eksperimen mengikuti langkah-langkah yang dijelaskan dalam manual.
d) Ukuran fragmen DNA abnormal sebelum ligasi adaptor Alasan untuk masalah ini mungkin disebabkan oleh kondisi reaksi yang salah selama fragmentasi DNA. Waktu reaksi yang berbeda harus digunakan untuk input DNA yang berbeda. Jika input DNA lebih dari 10 ng, kami merekomendasikan untuk memilih waktu reaksi 12 menit sebagai waktu mulai untuk optimasi, dan ukuran fragmen yang dihasilkan saat ini terutama dalam kisaran 300-500 bp. Pengguna dapat menambah atau mengurangi panjang fragmen DNA selama 2-4 menit sesuai dengan kebutuhan mereka sendiri untuk mengoptimalkan fragmen DNA dengan ukuran yang dibutuhkan.
A-2
a) Waktu Fragmentasi tidak dioptimalkan Jika DNA yang terfragmentasi terlalu kecil atau terlalu besar, silakan lihat Pedoman Pemilihan Waktu Fragmentasi yang disediakan dalam instruksi untuk menentukan waktu reaksi, dan gunakan titik waktu ini sebagai kontrol, selain itu atur sistem reaksi untuk memperpanjang atau mempersingkat 3 menit untuk membuat penyesuaian yang lebih akurat pada waktu fragmentasi.
A-3
Distribusi ukuran DNA yang tidak normal setelah perawatan fragmentasi
a) Metode pencairan reagen fragmentasi yang salah, atau reagen tidak tercampur sempurna setelah pencairan. Cairkan reagen Campuran Enzim Fragmentasi 5× di atas es. Setelah dicairkan, campur reagen secara merata dengan menjentikkan perlahan bagian bawah tabung. Jangan vortex reagennya!
b) Sampel masukan DNA mengandung EDTA atau polutan lainnya Penipisan ion garam dan zat pengkelat pada langkah pemurnian DNA sangat penting untuk keberhasilan percobaan. Jika DNA dilarutkan dalam 1 × TE, gunakan metode yang disediakan dalam instruksi untuk melakukan fragmentasi. Jika konsentrasi EDTA dalam larutan tidak pasti, dianjurkan untuk memurnikan DNA dan melarutkannya dalam air deionisasi untuk reaksi selanjutnya.
c) Kuantifikasi DNA awal yang tidak akurat Ukuran DNA yang terfragmentasi berkaitan erat dengan jumlah input DNA. Sebelum perlakuan fragmentasi, kuantifikasi akurat DNA menggunakan Qubit, Picogreen dan metode lainnya sangat penting untuk menentukan jumlah DNA yang tepat dalam sistem reaksi.
d) Persiapan sistem reaksi tidak mengikuti instruksi Persiapan sistem reaksi terfragmentasi harus dilakukan di atas es secara ketat sesuai dengan instruksi. Untuk memastikan efek terbaik, semua komponen reaksi harus ditempatkan di atas es dan persiapan sistem reaksi harus dilakukan setelah pendinginan total. Setelah persiapan selesai, silakan jentik atau pipet agar tercampur rata. Jangan vortex!
1. Metode pencampuran yang tidak tepat (vortex, osilasi keras, dll.) akan menyebabkan distribusi fragmen perpustakaan yang tidak normal (seperti yang ditunjukkan pada gambar berikut), sehingga mempengaruhi kualitas perpustakaan. Oleh karena itu, saat menyiapkan larutan reaksi Campuran Fragmentasi, harap pipet perlahan ke atas dan ke bawah untuk mengaduk, atau gunakan ujung jari untuk menjentikkan dan mengaduk secara merata. Hati-hati jangan sampai tercampur dengan vortex.

2. DNA dengan kemurnian tinggi harus digunakan untuk konstruksi perpustakaan
Integritas DNA yang baik: Pita elektroforesis lebih dari 30 kb, tanpa tailing
OD260/230: >1,5
OD260/280: 1.7-1.9
3. Jumlah input DNA harus akurat Disarankan untuk menggunakan metode Qubit dan PicoGreen untuk mengukur DNA, daripada Nanodrop.
4. Kandungan EDTA dalam larutan DNA harus ditentukan EDTA memiliki pengaruh yang besar terhadap reaksi fragmentasi. Jika kandungan EDTA tinggi, pemurnian DNA perlu dilakukan sebelum pengujian berikutnya.
5. Solusi reaksi fragmentasi harus disiapkan di atas es Proses fragmentasi sensitif terhadap suhu dan waktu reaksi (terutama setelah menambahkan enhancer). Untuk memastikan keakuratan waktu reaksi, harap siapkan sistem reaksi di atas es.
6. Waktu reaksi fragmentasi harus akurat Waktu reaksi dari langkah fragmentasi akan secara langsung mempengaruhi ukuran produk fragmen, sehingga mempengaruhi distribusi ukuran fragmen DNA di perpustakaan.
1. Jenis sampel apa yang berlaku untuk kit ini?
Jenis sampel yang berlaku dari kit ini dapat berupa RNA total atau mRNA murni dengan integritas RNA yang baik. Jika RNA total digunakan untuk membangun perpustakaan, disarankan untuk menggunakan kit deplesi rRNA (Cat#4992363/4992364/4992391) untuk menghapus rRNA terlebih dahulu.
2. Dapatkah sampel FFPE digunakan untuk membangun perpustakaan dengan kit ini?
MRNA dalam sampel FFPE akan terdegradasi sampai batas tertentu, dengan integritas yang relatif buruk. Saat menggunakan kit ini untuk pembangunan perpustakaan, disarankan untuk mengoptimalkan waktu fragmentasi (memperpendek waktu fragmentasi atau tidak melakukan fragmentasi).
3. Dengan menggunakan langkah pemilihan ukuran yang disediakan dalam manual produk, apa yang mungkin menyebabkan segmen yang dimasukkan tampak sedikit menyimpang?
Pemilihan ukuran harus dilakukan secara ketat sesuai dengan langkah pemilihan ukuran dalam manual produk ini. Jika ada penyimpangan, penyebabnya mungkin karena manik-manik magnetik tidak seimbang dengan suhu kamar atau tidak tercampur sempurna, pipet tidak akurat atau cairan tertinggal di ujung. Disarankan untuk menggunakan tip dengan adsorpsi rendah untuk percobaan.
4. Pemilihan adaptor dalam konstruksi perpustakaan
Kit konstruksi perpustakaan tidak mengandung reagen adaptor, dan disarankan untuk menggunakan kit ini bersama dengan TIANSeq Single-Index Adapter (Illumina) (4992641/4992642/4992378).
5. QC perpustakaan
Deteksi kuantitatif perpustakaan: Qubit dan qPCR masing-masing digunakan untuk menentukan konsentrasi massa dan konsentrasi molar perpustakaan. Operasi ini secara ketat sesuai dengan manual produk. Konsentrasi perpustakaan umumnya akan memenuhi persyaratan pengurutan NGS. Deteksi jangkauan distribusi perpustakaan: Menggunakan Agilent 2100 Bioanalyzer untuk mendeteksi jangkauan distribusi perpustakaan.
6. Pemilihan nomor siklus amplifikasi
Menurut instruksi, jumlah siklus PCR adalah 6-12, dan jumlah siklus PCR yang diperlukan harus dipilih sesuai dengan input sampel. Di perpustakaan hasil tinggi, amplifikasi berlebih biasanya terjadi dalam berbagai derajat, yang dimanifestasikan oleh puncak yang sedikit lebih besar setelah puncak kisaran target dalam deteksi Agilent 2100 Bioanalyzer, atau konsentrasi Qubit yang terdeteksi lebih rendah daripada qPCR. Amplifikasi lebih ringan adalah fenomena normal, yang tidak mempengaruhi pengurutan perpustakaan dan analisis data selanjutnya.
7. Paku muncul di profil deteksi Agilent 2100 Bioanalyzer
Munculnya spike pada deteksi Agilent 2100 Bioanalyzer disebabkan karena fragmentasi sampel yang tidak merata, dimana akan ada lebih banyak fragmen dalam ukuran tertentu, dan ini akan menjadi lebih jelas setelah pengayaan PCR. Dalam hal ini, disarankan untuk tidak melakukan pemilihan ukuran, yaitu mengatur kondisi fragmentasi ke 94°C selama 15 menit diinkubasi, di mana distribusi fragmen kecil dan terkonsentrasi, dan homogenitas dapat ditingkatkan.
Kategori produk
MENGAPA MEMILIH KAMI
Sejak didirikan, pabrik kami telah mengembangkan produk kelas dunia pertama dengan mengikuti prinsip
kualitas pertama. Produk kami telah mendapatkan reputasi yang sangat baik di industri dan kepercayaan yang berharga di antara pelanggan baru dan lama..