Kit PCR (MSP) khusus metilasi
Fitur
Produk ini memiliki keunggulan kecepatan, kesederhanaan, sensitivitas tinggi, spesifisitas yang kuat dan stabilitas yang baik.
Spesifikasi
Jenis: MSP DNA Polimerase
Templat: <500ng
Aplikasi: Sangat cocok untuk metode PCR spesifik metilasi (MSP) untuk menganalisis karakteristik metilasi DNA genom
Semua produk dapat disesuaikan untuk ODM/OEM. Untuk detailnya,silahkan klik Layanan yang Disesuaikan (ODM/OEM)
1. Kit PCR (MSP) Metilasi Spesifik diterapkan untuk mengamplifikasi fragmen 400 bp menggunakan DNA genom yang diberi perlakuan bisulfit sebagai templat dengan sistem reaksi 20 l .

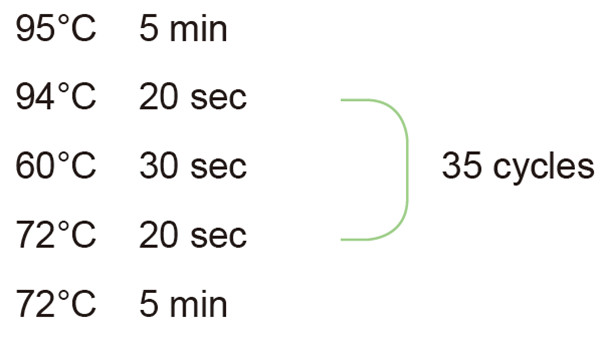
2. Pengaturan siklus reaksi PCR
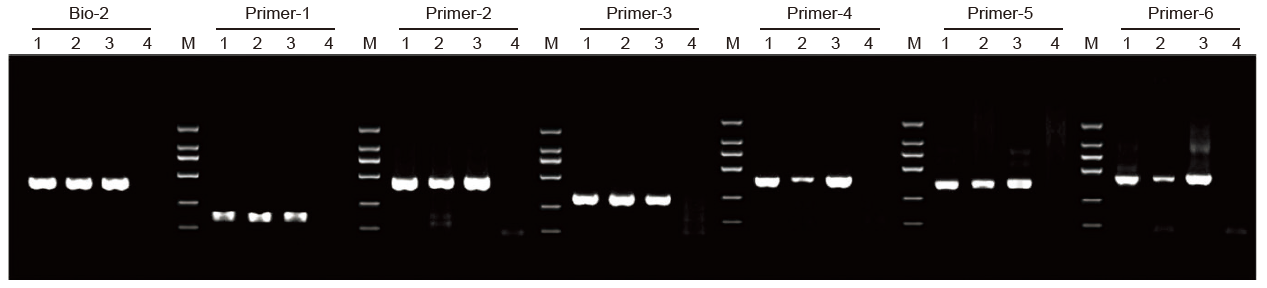 |
1: Sampel yang diproses oleh Pemasok A; 2: Sampel yang diproses oleh Pemasok B; 3: sampel yang diberi perlakuan TIANGEN 4: NTC; M: D2000 |
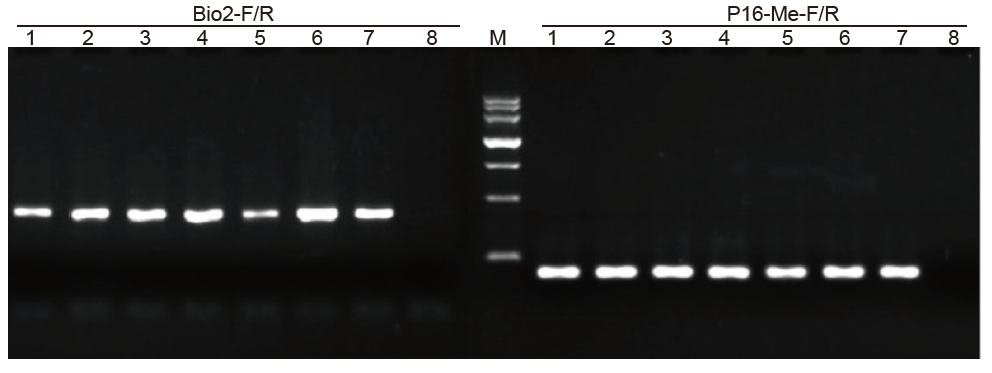 |
1-6: 6 pengulangan; 7: Pemasok Sampel yang diproses; 8: NTC; Bio2-F/R dan P16- Me-F/R: Dua primer deteksi. |
Template A-1
Templat mengandung pengotor protein atau penghambat Taq, dll. ——Memurnikan templat DNA, menghilangkan pengotor protein atau mengekstrak DNA templat dengan kit pemurnian.
Denaturasi template tidak lengkap ——Secara tepat meningkatkan suhu denaturasi dan memperpanjang waktu denaturasi.
Degradasi template ——Siapkan ulang template.
A-2 Primer
Kualitas primer yang buruk ——Mensintesis ulang primer.
Degradasi primer ——Alikuot primer konsentrasi tinggi ke dalam volume kecil untuk pengawetan. Hindari pembekuan dan pencairan berulang kali atau kriopreservasi 4°C jangka panjang.
Desain primer yang tidak tepat (misalnya panjang primer tidak cukup, dimer terbentuk di antara primer, dll.) -Desain ulang primer (hindari pembentukan dimer primer dan struktur sekunder)
A-3 Mg2+konsentrasi
Mg2+ konsentrasi terlalu rendah ——Meningkatkan Mg . dengan benar2+ konsentrasi: Optimalkan Mg2+ konsentrasi dengan serangkaian reaksi dari 1 mM sampai 3 mM dengan interval 0,5 mM untuk menentukan Mg optimal2+ konsentrasi untuk setiap template dan primer.
A-4 Suhu anil
Temperatur annealing yang tinggi mempengaruhi pengikatan primer dan template. ——Kurangi suhu annealing dan optimalkan kondisi dengan gradien 2°C.
A-5 Perpanjangan waktu
Waktu perpanjangan singkat——Meningkatkan waktu perpanjangan.
Fenomena: Sampel negatif juga menunjukkan pita urutan target.
A-1 Kontaminasi PCR
Kontaminasi silang dari rangkaian target atau produk amplifikasi —— Hati-hati jangan sampai mem-pipet sampel yang mengandung urutan target dalam sampel negatif atau menumpahkannya keluar dari tabung sentrifus. Reagen atau peralatan harus diautoklaf untuk menghilangkan asam nukleat yang ada, dan keberadaan kontaminasi harus ditentukan melalui eksperimen kontrol negatif.
Kontaminasi reagen ——Alikuot reagen dan simpan pada suhu rendah.
A-2 Perdanar
Mg2+ konsentrasi terlalu rendah ——Meningkatkan Mg . dengan benar2+ konsentrasi: Optimalkan Mg2+ konsentrasi dengan serangkaian reaksi dari 1 mM sampai 3 mM dengan interval 0,5 mM untuk menentukan Mg optimal2+ konsentrasi untuk setiap template dan primer.
Desain primer yang tidak tepat, dan urutan target memiliki homologi dengan urutan non-target. ——Desain ulang primer.
Fenomena: Pita amplifikasi PCR tidak konsisten dengan ukuran yang diharapkan, baik besar atau kecil, atau kadang-kadang terjadi pita amplifikasi spesifik dan pita amplifikasi non-spesifik.
A-1 Primer
Spesifisitas primer yang buruk
——Desain ulang primer.
Konsentrasi primer terlalu tinggi ——Meningkatkan suhu denaturasi dengan benar dan memperpanjang waktu denaturasi.
A-2 Mg2+ konsentrasi
Mg2+ konsentrasi terlalu tinggi —— Kurangi konsentrasi Mg2+ dengan benar: Optimalkan Mg2+ konsentrasi dengan serangkaian reaksi dari 1 mM sampai 3 mM dengan interval 0,5 mM untuk menentukan Mg optimal2+ konsentrasi untuk setiap template dan primer.
A-3 polimerase termostabil
Jumlah enzim yang berlebihan ——Kurangi jumlah enzim secara tepat pada interval 0,5 U.
A-4 Suhu anil
Suhu anil terlalu rendah ——Secara tepat meningkatkan suhu anil atau mengadopsi metode anil dua tahap
Siklus PCR A-5
Terlalu banyak siklus PCR ——Kurangi jumlah siklus PCR.
A-1 Primer——Kekhususan yang buruk ——Desain ulang primer, ubah posisi dan panjang primer untuk meningkatkan spesifisitasnya; atau melakukan PCR bersarang.
A-2 Template DNA
——Templat tidak murni ——Memurnikan templat atau mengekstrak DNA dengan kit pemurnian.
A-3 Mg2+ konsentrasi
——Mg2+ konsentrasi terlalu tinggi ——Reduksi Mg . dengan benar2+ konsentrasi: Optimalkan Mg2+ konsentrasi dengan serangkaian reaksi dari 1 mM sampai 3 mM dengan interval 0,5 mM untuk menentukan Mg optimal2+ konsentrasi untuk setiap template dan primer.
A-4 dNTP
——Konsentrasi dNTP terlalu tinggi ——Kurangi konsentrasi dNTP dengan tepat
A-5 Suhu anil
——Suhu anil terlalu rendah ——Meningkatkan suhu anil dengan tepat
A-6 Siklus
——Terlalu banyak siklus ——Mengoptimalkan jumlah siklus

Langkah pertama adalah memilih polimerase yang sesuai. Taq polimerase reguler tidak dapat mengoreksi karena kurangnya aktivitas eksonuklease 3'-5', dan ketidakcocokan akan sangat mengurangi efisiensi ekstensi fragmen. Oleh karena itu, Taq polimerase biasa tidak dapat secara efektif mengamplifikasi fragmen target yang lebih besar dari 5 kb. Taq polimerase dengan modifikasi khusus atau polimerase kesetiaan tinggi lainnya harus dipilih untuk meningkatkan efisiensi ekstensi dan memenuhi kebutuhan amplifikasi fragmen panjang. Selain itu, amplifikasi fragmen panjang juga memerlukan penyesuaian desain primer, waktu denaturasi, waktu ekstensi, pH buffer, dll yang sesuai. Biasanya, primer dengan 18-24 bp dapat menghasilkan hasil yang lebih baik. Untuk mencegah kerusakan template, waktu denaturasi pada 94°C harus dikurangi menjadi 30 detik atau kurang per siklus, dan waktu untuk menaikkan suhu ke 94°C sebelum amplifikasi harus kurang dari 1 menit. Selain itu, pengaturan suhu perpanjangan sekitar 68°C dan merancang waktu perpanjangan menurut kecepatan 1 kb/menit dapat memastikan amplifikasi efektif dari fragmen panjang.
Tingkat kesalahan amplifikasi PCR dapat dikurangi dengan menggunakan berbagai DNA polimerase dengan fidelitas tinggi. Di antara semua Taq DNA polimerase yang ditemukan sejauh ini, enzim Pfu memiliki tingkat kesalahan terendah dan kesetiaan tertinggi (lihat tabel terlampir). Selain pemilihan enzim, peneliti selanjutnya dapat mengurangi laju mutasi PCR dengan mengoptimalkan kondisi reaksi, termasuk mengoptimalkan komposisi buffer, konsentrasi polimerase termostabil, dan mengoptimalkan nomor siklus PCR.
Kategori produk
MENGAPA MEMILIH KAMI
Sejak didirikan, pabrik kami telah mengembangkan produk kelas dunia pertama dengan mengikuti prinsip
kualitas pertama. Produk kami telah mendapatkan reputasi yang sangat baik di industri dan kepercayaan yang berharga di antara pelanggan baru dan lama..








